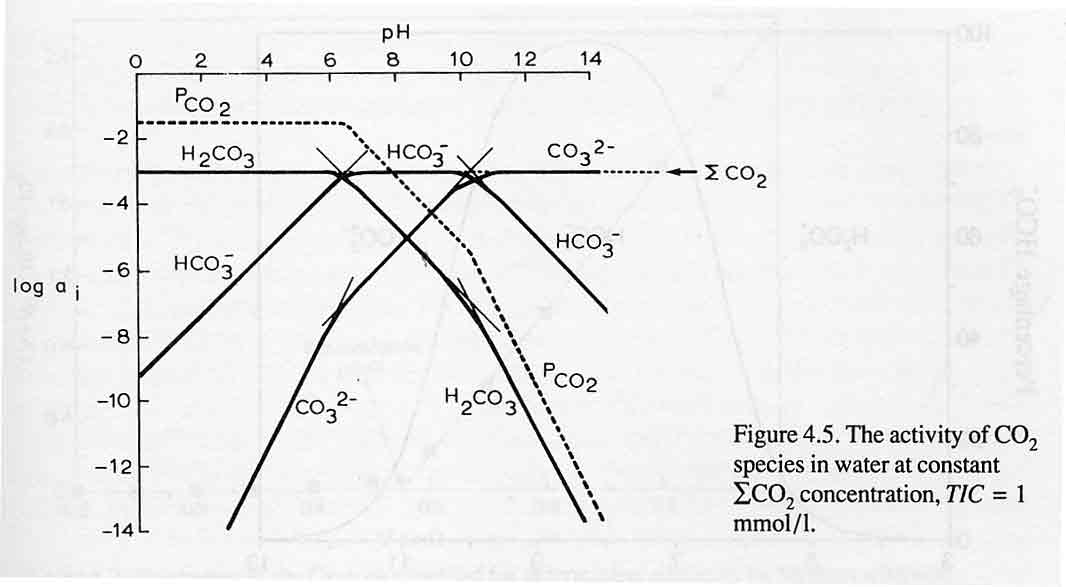
出典:Geochemistry, groundwater and pollution (CAJ Appelo, D.Postma)
<このWeb sitesは,Geocitiesの閉鎖に伴いこのサイトに移設しました。>
<上記は,Geocitiesのスポンサーです.私のWebは以下から始まります.>
筆者よりお願い:計算が間違えていたら教えて下さい。でも、こんなんで間違えていたら恥ずかしいなぁ〜。
HCO3-を含めた溶存炭酸種の濃度は、炭酸塩鉱物との平衡である。
溶液中の化学成分の活動度は、材料物質の組成と安定性によって決定される。
水溶液中でどの様な鉱物が形成されるかは、活動度によって規制される。
溶存炭酸化学種
その溶解を示す平衡定数(溶解度積)をKCaCO3、地下水中のCaCO3の溶解度積に対する活動度積をQとすると
Q = aCa2+ × aCO32-
SI = log ( Q / KCaCO3 )
SIがゼロの時は、溶解度積と活動度積が等しいことから、地下水はCaCO3に対して「飽和」している。SIが正であれば、地下水は熱力学的にCaCO3に対して「過飽和」であることから、CaCO3は沈殿しており、逆に負であれば「不飽和」であることからCaCO3が溶け出すと推定できる。
実際の計算例を以下に示す。
なお以下に示す式において[ ]は活動度で示されるものであるが、非常に薄い溶液中では、濃度で示すことが出来る。
[Alk] = [HCO3-] + [CO32-] + [OH-] - [H+]
=3.20x10-3(mol/kg)
10-10.3 = [CO32-][H+] / [HCO3-]
10-14 = [H+][OH-] / [H2O] ([H2O]=1)
[H+] = 10-6.96
[OH-] = 10-14 / 10-6.96 = 10-7.04
[HCO3-] = [CO32-][H+] / [10-10.3]
[Alk] = [HCO3-] + [CO32-] + [OH-] - [H+]
= ( [CO32-] × 10-6.96 / 10-10.3 ) + [CO32-] + 10-7.04 - 10-6.96
[Alk] - 10-7.04 + 10-6.96 = [CO32-] × ( 103.34 + 1 )
[CO32-] = 1.5x10-6 (mol/kg)

出典:Geochemistry, groundwater and pollution (CAJ Appelo, D.Postma)
[Ca2+] × [CO32-]
32.13(mg/L) : 32.13x(1/40.08/2) = 1.603 (meq/L) : 1.603x10-3 (mol/kg) (1L=1kg)
( 1.6x10-3 ) × ( 1.5x10-6 ) = 2.4x10-9 (mol/kg)
2.4x10-9 / 10-8.4 = 0.603
SI = log0.603 = -0.22
正は過飽和で沈殿するだろう、負は不飽和で溶解するだろう
飽和の範囲は、おおむね±0.37と考えて良い。
従って、本試験水は炭酸カルシウムに対して、熱力学的に飽和していると言える。
あわせてEh-pHダイヤグラムにプロットして、確認すると良い。
Fe(OH)3 <-> Fe3+ + 3OH- 溶解度積 Ksp = 10-37.2
平衡定数K = [Fe3+][OH-]3 / [Fe(OH)3]
溶解度積Ksp = [Fe3+][OH-]3 = 10-37.2
logKsp = log[Fe3+] + 3log[OH-]
Kw = [H+][OH-] = 10-14
log[H+] + log[OH-] = -14
log[OH-] = -14-log[H+] = pH -14
LogKsp = log[Fe3+] + 3 ( pH -14)
-37.2 = log[Fe3+] + 3pH -42
log[Fe3+] = -3pH +4.8
OR
Fe3+ + e <-> Fe2+ Eo = 0.771(Volt) at 25oC,1 atm
Eh = Eo + (RT / nF ) ln ( [Dox]d / [Bred]b )
Eh = Eo + (RT / nF ) ln ( [Fe3+] / [Fe2+] )
= 0.771 + ( ( (8.314x10-3)(298.15)(2.303) ) / 96.2 ) log ( [Fe3+] / [Fe2+] )
= 0.771 + 0.059 log ( [Fe3+] / [Fe2+] )
「とっつきやすい」もののみ
ホームページに戻る このサイトについて
Copyright(c) 2002 - 2003, ![[always in the field]](../envpepl.gif) KOBAYASHI Shigeru, JAPAN
KOBAYASHI Shigeru, JAPAN
Yahoo Geocitiesの閉鎖に伴い、このホスティングサービスに移設しました。